岩手県立総合教育センター教育研究(1999)
高等学校化学「酸化還元反応」の電気分野の学習において現象や法則の理解を深める教材の開発に関する研究 【第1年次】
目 次
1 はじめに
2 「酸化還元反応」の電気分野の学習指導についての基本的な考え方
3 現象や法則の理解を深める教材の開発
(1) 教材開発の基本方針
(2) 開発教材の概要
(3) 教材の製作手順
4 開発教材を硫酸銅水溶液の電気分解に活用する方法
(1) 実験操作手順
(2) 実験データの整理について
(3) 実験結果および考察
(4) 開発教材を硫酸銅水溶液の電気分解実験に活用したときの有効性について
5 開発教材を二次電池に活用する方法
(1) 扱う実験素材について
(2) 実験操作手順
(3) 実験結果および考察
(4) 開発教材を二次電池のモデルに活用したときの有効性について
6 研究のまとめ
7 おわりに
文 献
1 はじめに
高等学校化学ⅠB「酸化還元反応」の単元では、「化学反応には電子の授受に関係した反応があり、電気分解や電池の反応も酸化還元反応である」ことを理解させることをねらいとしています。この電気分解や電池などの電気に関する技術は、今日の社会生活において、また、これからの技術社会を生きていくために基礎的知識として必要です。そのため、観察、実験をとおして、酸化還元反応に関する電気分野の学習を深め、その学習内容を、科学的概念の基礎として生徒に定着させることが重要となります。
しかし、電子の授受は目に見えないことから、酸化還元反応は抽象的な概念でとらえられがちです。また、この電気分野の現象や法則を確認できる効果的な実験教材も不足していることから、授業においては、実際に感覚を通した観察、実験よりは、教科書による現象の暗記や問題練習を中心にした学習になりがちであり、生徒が十分に現象や法則を理解しているとは言い難い状況にあります。その結果、生徒にとって、この分野は苦手なものとなっております。
このような状況を改善するためには、酸化還元反応を背景にもち、生徒に興味関心を起こさせ、かつ現象や法則の理解を深めさせることができるような教材が必要であり、そのような教材を積極的に授業に取り入れていくことが重要となります。
そこでこの研究では、「酸化還元反応」の電気分野の学習において、現象や法則の理解を深めるために効果的な実験教材を開発し、高等学校化学の学習指導の改善に役立てようとするものです。
この研究は、平成11年度から平成12年度にわたる2年次研究であります。
2 「酸化還元反応」の電気分野の学習指導についての基本的な考え方
高等学校化学ⅠB「酸化還元反応」の単元では、中学校段階での酸素の授受による定義から、電子の授受による定義に考え方を広めて学習することになっています。この定義によれば、電池や電気分解といった実用的で工業的に重要な現象も酸化還元反応に含まれることになり、高等学校化学の学習においても大切な単元と位置づけられています。
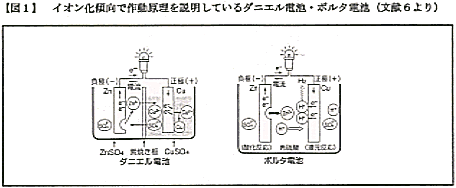
しかし、電池に関して、教科書では、次頁図1に示すとおり、その動作原理を金属のイオン化列(イオンになりやすい順序K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H2)>Cu>Hg>Ag>Pt>Au)だけで説明しようとしています。そのため、次頁図2に示すような実用電池の電極反応について、統一的な説明がなされず電池の種類ごとに各論的に説明しており、授業でもそのような指導がなされています。電池の原理を金属のイオン化列だけに求めず、もっと一般的に酸化還元反応の親和力に考え方を広げれば説明を統一でき、生徒の理解も深められるはずですが、そのような効果的な教材がない状況にあります。
また、電気分解に関して、教科書では、多くの種類の溶液を電気分解して、生成する物質や重要な法則である“ファラデーの法則”を教えています。例えば、教科書では次のような例題が登場します。
しかし、教科書でファラデーの法則を確認する実験は、課題研究のテーマとして扱われていますが、その方法は、図3に示すとおり、両電極に銅板を用いて銅の質量変化から確認することにしており、例題のような気体が発生するような実験を検証できる教材例は示されていません。
また図録でも、次頁図4に示すように、中学校で扱うホフマン型の電解装置で水の電気分解を行い、発生する酸素と水素の体積からファラデーの法則を説明していますが、例題のような硫酸銅水溶液の電気分解の実験は扱われておりません。
すなわち、教科書や図録を用いた授業だけでは硫酸銅水溶液の電気分解を、生徒に実感をともなって教えることが困難であり、また、適切な教材もないことから、教師も現象を確認する実験だけにとどめて、ファラデーの法則を導く実験指導までには至っていない状況にあります。
そのため、授業では問題演習中心になりがちです。理科では、実体験が重要視されているにもかかわらず現実に体験できない現象を問題として解かなければならず、生徒にとっては重要な現象を観念的に考えることを強いられて、この分野の学習に興味関心が持てないとともに、苦手としている生徒が多い現状にあります。したがって、酸化還元反応の電気分野の学習指導において現在必要とされている教材をまとめると次のようになり、このような教材を授業に取り入れることができれば、この分野における生徒の理解が深められると考えます。
① 酸化還元反応の親和力で電池の原理を統一的に理解できる教材
② 電気分解において発生気体の体積からもファラデーの法則が理解でき、その気体を同定できる教材
以上のことをまとめると、次頁図5のようになります。
[参考]ファラデーの法則とは、
(1)陰極または陽極で変化する物質の量は流した電気量に比例する
(2)一定の電気量を流したとき、電極で変化するイオンの物質量はイオンの種類によらず、そのイオンの価数に反比例する
3 現象や法則の理解を深める教材の開発
(1) 教材開発の基本方針
電池には、放電のみを行うことができる一次電池と放電・充電を繰り返し行うことができる二次電池がありますが、二次電池の充電とは電気分解のことに他なりません(正極活物質が陽極に、負極活物質が陰極に完全に再生させるために充電を行う)。そこで、教材開発を行うにあたり、電池の原理と電気分解の両方の現象の理解を深めることができる教材として次の点を念頭に置きながら電気分解装置の開発を考えました。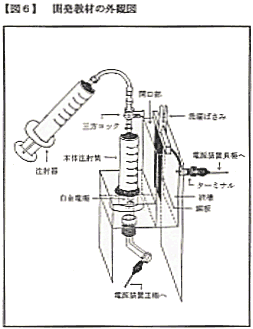
① 生徒が理解しやすい簡単な原理を用いたもの。
② 生徒が扱いやすいように操作が簡単なもの。
③ 観察しやすいように装置全体が見やすいもの。
④ 繰り返し実験のできるもの。
⑤ 自作しても実験誤差が小さくなるもの。
⑥ 誰でも製作が可能であるもの。
⑦ 安価に製作できるもの。
(2) 開発教材の概要
装置の外観は図6のとおりです。特徴とし
て、次のことが挙げられます。
① アクリル板を使用することで、反応状態が見やすい。
② 三方コックを使用することで、本体注射筒内部に溶液を満たすことや、
発生気体を捕集することが可能。
③ 金属板は質量測定のため、取り外しやすいように洗濯ばさみで固定。
④ 実験途中からの再実験が簡単。
(3) 教材の製作手順
ア 気体捕集管の製作
注射器を気体の捕集管として利用します。注射器の先端部分にはピストンの先端部分と型を合わせるために余分な空間がありますが、この部分を埋めれば、注射器についている目盛りはかなり正確に気体の体積を読み取ることができます。
したがって、次頁図7に示すとおり以下の手順で気体捕集管の作成を行いました。
① ピストンの先端部分のゴムをカッターで平面的に切り取る。
② 切り取ったゴムの内部に存在する空間を埋めるため、発砲スチロール球の一部を切り取り、ゴムの内部に接着する。
③ 気体捕集管内部を外部から吸引できるようにするために、千枚通しを加熱して小さい穴を開ける。
④ ゴムの上部に接着剤を塗って、注射筒上部に接着する(ゴムの穴の位置に注意する)。
イ 気体捕集部分の製作
気体捕集部分の作製を図8に示すとおり以下の手順で行いました。
① アクリル板を8×6cmに切り取り、その中央にA2.6cmの穴を開ける。
② その穴に気体捕集管となる注射筒を通し、隙間をエポシキ樹脂系の接着パテで塞ぐ。
① アクリル板を8×9cmに切り取る。 ② そのアクリル板の9cmの辺の長さを6cmと3cmに分け、8×6cmの中央にA1.6cmの穴を開ける。 ③ 内径1.6cm(外径2.0cm)のアクリル管を長さ1.5cmに切り取り、②の穴の部分に接着する。 |
図10に示すとおりアクリル板を切り取り、 事前に製作しておいた気体捕集部分のパーツも含めて互いを接着します。なお、銅板を固定するアクリル角棒にはステンレスシートを張り付け、近くのアクリル板には、ターミナ ルを付けるための小さい穴を開けます。完成 後は、水を入れて漏れている箇所がないか確認します。 |
(1) 実験操作手順
開発した教材は、以下の手順にしたがって電気分解実験に活用することにしました。装置に流す電流値を一定にするために、はじめに予備実験を行わなければなりません。
① 装置下部に白金電極を取り付ける。
② 装置の開口部から0.5M-CuSO4・5H2Oを注ぎ入れる。
③ 装置の注射筒の先端に、注射器付きの三方コックを取り付ける。
④ 銅板を液槽に入れて溶液に浸すとともにアクリル角棒に接触させて、洗濯バサミで固定する。
⑤ 流す電流を一定にするために予備実験として、白金電極と銅板をそれぞれ外部電源の正極・負極に接続し、電源をONにして電流計を見ながら電流値を300mAに合わせるために電源装置のつまみを調節する。
⑥ 電流値が300mAに一定した後、電源を一端OFFにする。
-------------------------
⑦ 銅板を、質量を測定してあるものに取り替えてから再び電源装置に接続する。
⑧ 三方コックを操作して注射器のピストンを引いて注射筒内部に硫酸銅水溶液を満たす。
⑨ 電源をONにして、時間を正確に測定しながら2分おきに電源をOFFにする。
⑩ 電源をOFFにした後、注射筒内部の水位と液槽の水位を揃えて(液槽内部の水溶液をスポイトで吸い取る)、注射筒の目盛りで発生気体の体積を読み取る。
⑪ 銅板をアクリル棒から取り外し、水で洗い流してからエタノールに浸して水を除去し乾燥させてから質量を測定する。
⑫ 2分おきに同じ操作をくり返し、データを収集する。
(2) 実験データの整理について
ア 発生気体(酸素)の体積の理論値の求め方
陽極の白金電極では、次のような反応が起こっています。
2H2O → O2 + 4H+ + 4e-
すなわち、酸素が1モル発生する時には、電子が4モル必要であることがわかります。そこで、注射筒内部の酸素の分圧と水蒸気圧の和が大気圧と釣り合っていれば(図11参照)、次の式で理論値を求めることが可能となります(ただし、発生気体の温度は水溶液の温度と一致しているものと見なします)。
イ 析出する銅の質量の理論値の求め方
陰極の銅板では、次のような反応が起こっています。
Cu2+ + 2e- → Cu
すなわち、銅が1モル析出する時には、電子が2モル必要であることがわかります。そこで、次の式で理論値を求めることが可能となります。
(3) 実験結果および考察
ア 生成物と流した電気量の関係
陰極に析出した銅の質量および陽極で発生した気体の体積と流した電気量との間には、図12・13のグラフのとおり比例関係にあることが確認できます。このことから、ファラデーの電気分解の第一法則が確かめられます。
また、実験開始から20分を経過して、O2の誤差率は1.7%、Cuの誤差率は0.0027%でした。酸素の理論値と実測値の間に少し開きがあったことに関しては、溶液中に溶解した酸素の影響があったためではないかと思われます。実験に用いた水溶液の量は500?と多量であり、酸素は水に溶けにくい気体ではありながら、溶解量を無視できない結果があらわれたものと思われます。しかし、酸素の発生量・銅の析出量ともに誤差の程度は小さく、実験結果として有効なデータが得られたものと考えます。
イ 一定の電気量によって変化する物質量とイオンの価数の関係
上記の計算結果より、一定の電気量を流したとき、電極で変化するイオンの物質量は、イオンの価数に反比例することが確認できます。このことから、ファラデーの電気分解の第二法則が確かめられます。
ウ 発生した気体の定性分析
発生した気体を捕集して燃えている線香を近づけたところ、激しく燃えたことから、陽極に発生した気体は酸素であることが確認できます。
(4) 開発教材を硫酸銅水溶液の電気分解実験に活用したときの有効性について
今回開発した教材を用いて硫酸銅水溶液の電気分解実験を行えば、ファラデーの法則の確認や発生気体の定性分析が可能であることが(3)の実験結果および考察から明らかです。このことから、この開発教材はこの実験において十分有効であると考えます。
5 開発教材を二次電池に活用する方法
(1) 扱う実験素材について
二次電池を作動させるためには、電気分解による正極・
負極の各活物質が充電(電気 分解)によって再生されるこ
とが必要です。充電(電気分 解)によって陽極で水溶液か
ら生成される代表的な酸化剤 には、塩素(Cl2)・臭素(Br2)・
ヨウ素(I2)が考えられます。 塩素・臭素・ヨウ素は元素の
周期表(図14参考)では同 じ17族に属し、ハロゲンと
呼ばれています。このハロゲ ンはいずれも1価の陰イオン
になりやすく(反応相手から 電子を受け取りやすい、すなわち酸化剤となり得る)、酸化剤としての強さは、
塩素(Cl2)>臭素(Br2)>ヨウ素(I2)
の順です。これは高校化学で必ず学習する内容となっており、酸化剤として扱う素材として申し分ないものと考えられます。一方、充電(電気分解)によって陰極で水溶液から生成される代表的な還元剤には、ほとんどすべての電池で用いられている亜鉛(Zn)が考えられます。亜鉛は比較的イオン化傾向が大きいので2価の陽イオンになりやすいです(反応相手に電子を与えやすい、すなわち還元剤となり得る)。また、イオン化傾向の大きいナトリウム、マグネシウム、アルミニウムのように、その塩類の水溶液を電気分解しても水素は発生せず、亜鉛単体が析出します。
したがって、二次電池のモデルに扱う素材として、亜鉛-ハロゲン系電池が最もふさわしいと考えて、電解液にハロゲン化亜鉛水溶液を、電極に白金電極と亜鉛板を用いることにしました(ハロゲン-亜鉛電池の充電・放電反応は図15に示すとおりです)。
(2) 実験操作手順
開発した教材は、以下の手順にしたがって二次電池実験に活用することにしました。電池としての作動確認はソーラーモーターを、電圧測定にはデジタルマルチメーターを使用します。
① 装置開口部から0.5M-ZnCl2(or
ZnBr2 or ZnI2)を注ぎ入れる。
② 装置下部に白金電極を取り付ける。
③ 亜鉛板を液槽に入れて溶液に浸すとともにアクリル角棒に接触させて、洗濯バサミで固定する。
④ 白金電極と亜鉛板をそれぞれ電源の正極、負極に接続する。
⑤ 電源をONにして、数分間電気分解(充電)を行う。
(それぞれの電極で活物質となるハロゲンと亜鉛が生成されればいいので、電流値や時間は特に定めない)
陽極で起こる変化を観察する。
⑥ 電源をOFFにして、リード線を電源装置からはずし、ソーラーモーターに接続する。
(電池として作動するか、ソーラーモーターの回転で確認する)
───────────────────
⑦ 再び数分間電気分解を行ってそれぞれの電極に活物質を生成させてから、それぞれの電極をデジタルマルチメーターに接続して電池としての起電力を測定する。
(3) 実験結果および考察
ア 電気分解(充電)時における陽極の変化
塩化亜鉛水溶液を電気分解した時に生成する気体は、臭いや水に対する溶解度が大きいことなどから判断して塩素と考えられます。
臭化亜鉛水溶液を電気分解した時に生成する褐色物質は、色から判断して臭素と考えられます。また、同時に生成する気体は、水の電気分解による酸素と考えられます。
ヨウ化亜鉛水溶液を電気分解した時に生成する赤褐色物質は、色から判断してヨウ素と考えられます。本来、固体のヨウ素は水に溶けにくいが、ヨウ素イオンが共存している場合には、
I2 + I-→I3- という反応が起こり、ヨウ素溶液になっているものと考えられます。また、同時に生成する気体は、臭化亜鉛の電気分解のときと同様、水の電気分解による酸素と考えられます。
いずれの水溶液の電気分解においても、酸化剤と成り得るハロゲンが生成してきていることが確かめられました。
イ 電池としての起電力
電気分解後、すぐにソーラーモーターに接続するとモーターを回転させることから、電池が形成されていることが確かめられます。また、その起電力は、表3の標準酸化還元電位の差から理論値を求めることができます。各水溶液を電気分解したときの起電力の実験値と理論値は次の表のとおりになりました。
標準酸化還元電位の異なる化学種同士で電池を作った場合、電位の高い方が正極、電位の低い方が負極となります。つまり、各ハロゲン-亜鉛電池の作動原理は以下のとおりとなっています。
起電力の実験値は、ここで求めた理論値にかなり近い値を示しており、電池としての性能の精度の高さが確かめられました。
(4) 開発教材を二次電池のモデルに活用したときの有効性について
今回開発した教材を用いてハロゲン化亜鉛水溶液を実験素材として充電(電気分解)を行えば、理論値に近い起電力を示し、かつソーラーモーターを回転させることから放電も正確に機能していることが(3)の実験結果および考察から明らかです。このことから、この開発教材はハロゲン化亜鉛水溶液を実験素材に用いれば、二次電池のモデル実験において十分有効であると考えます。
6 研究のまとめ
本年度は、2年次研究の1年次であり、研究成果として次の4点をあげることができます。
① 主題にかかわる先行研究と文献により、「酸化還元反応」の電気分野の学習指導のあり方について検討することができた。
② 教材開発の基本方針に基づき、誰でも安価に製作でき、しかも取り扱いやすい教材を開発することができた。
③ 開発教材は、硫酸銅水溶液の電気分解実験において十分有効であることがわかった。
④ 開発教材は、ハロゲン化亜鉛水溶液を実験素材に用いれば、二次電池のモデル教材として十分有効であることがわかった。
7 おわりに
この研究を進めるにあたり、研究協力員として御協力いただいた岩手県立盛岡第三高等学校教諭の金子剛先生に心から厚く御礼申し上げます。
文 献
1) 化学と教育, 45, 398(1997).
2) 化学と教育, 45, 531(1997).
3) 萩谷薫・三村千春・市毛正道,日本理化学協会・全国理科教育大会発表資料集(1997)210-c111.
4) 日本分析化学会編, 分析化学データブック(改訂3版),
丸善(株)(1983)p.131.
5) 日本化学会編, 高校化学の教え方, 丸善(株)(1997)p.85.
6) 教科書:東京書籍, 化学ⅠB
7) 教科書:東京書籍, 化学Ⅱ
8) 図 録:東京書籍, ビジュアルワイド図説化学
9) 田中善正・大倉洋庸・斉藤 寛, 分析化学Ⅰ(改訂4版),
南江堂(1997)p.81.
10) 重松栄一, 化 学 ~物質の世界を正しく理解するために~,
民衆社(1996)p.314.
11) ト部吉庸, 化学ⅠB・Ⅱの新研究, 三省堂(1997)p.280.