岩手県立総合教育センター教育研究(2000)
高等学校化学「酸化還元反応」の電気分野の 学習において現象や法則の理解を深める教材の開発に関する研究(第2報)
《 目 次 》
はじめに
1 酸化還元反応の電気分野の学習指導についての基本的な考え方
(1) 電池の学習指導について
(2) 電気分解の学習指導について
(3) 電気分解を考慮した二次電池の学習指導について
2 化学の学習における生徒の実態について
3 現象や法則の理解を深める教材の開発
(1) 教材開発の基本方針
(2) 開発教材の概要
4 硫酸銅水溶液の電気分解に活用する方法
(1) 実験操作手順
(2) 実験データの整理について
(3) 実験結果および考察
5 二次電池に活用する方法
(1) 扱う実験素材について
(2) 実験操作手順
(3) 実験結果および考察
6 開発実験教材を用いた授業実践
(1) 学習指導試案の概要
(2) 指導実践及び実践結果の分析と考察
7 研究のまとめと課題
おわりに
【参考文献】
はじめに
高等学校化学ⅠB「酸化還元反応」の単元では、「化学反応には電子の授受に関係した反応があり、電気分解や電池の反応も酸化還元反応である」ことを理解させることをねらいとしています。この電気分解や電池などの電気に関する技術は、今日の社会生活において、また、これからの技術社会を生きていくために基礎的知識として必要です。そのため、観察、実験を通して、酸化還元反応に関する電気分野の学習を深め、その学習内容を、科学的概念の基礎として生徒に定着させることが重要となります。
しかし、電子の授受は目に見えないことから酸化還元反応は抽象的な概念でとらえられがちです。また、この電気分野の現象や法則を確認できる効果的な実験教材も不足していることから、授業においては、実際に感覚を通した観察、実験よりは、教科書による現象の暗記や問題練習を中心にした学習になりがちであり、生徒が十分に現象や法則を理解しているとは言い難い状況にあります。その結果、生徒にとって、この分野は苦手なものとなっております。
このような状況を改善するためには、酸化還元反応を背景に持ち、生徒に興味・関心を起こさせ、かつ現象や法則の理解を深めさせることができるような教材が必要であり、そのような教材を積極的に授業に取り入れていくことが重要となります。
そこでこの研究では、「酸化還元反応」の電気分野の学習において、現象や法則の理解を深めるために効果的な実験教材を開発し、高等学校化学の学習指導の改善に役立てようとするものです。
この研究は、平成11年度から平成12年度にわたる2年次研究であり、今年度は2年次となります。昨年度は、観察、実験をとおして、生徒に興味・関心を起こさせ、電池と電気分解の両方の現象とその現象の法則の理解を深める教材の開発を行いました。今年度は、授業実践をとおして開発教材の有効性を検討しました。
1 酸化還元反応の電気分野の学習指導についての基本的な考え方
(1) 電池の学習指導について
高等学校化学ⅠB「酸化還元反応」の単元では、中学校段階での酸素の授受による定義から、電子の授受による定義に考え方を広めて学習することになっています。この定義によれば、電池や電気分解といった実用的で工業的に重要な現象も酸化還元反応に含まれることになり、高等学校化学の学習においても大切な単元と位置付けられています。
しかし、電池に関して、教科書では、その動作原理を金属のイオン化傾向(イオンになりやすい順序K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H2)>Cu>Hg>Ag>Pt>Au)で説明しようとしています。これは、これまでの学習指導要領における電池の扱いに大きく影響を受けているように思われます。電池は、1990年以前は金属のイオン化傾向と関連づけて教えることになっており、酸化還元反応であることを明確に扱うようになった現在の学習指導要領になった今でも、教科書ではまずはじめに亜鉛と銅のイオン化傾向の違いにより作動するダニエル電池を扱うことになっています。ダニエル電池自体は単純な反応であり教材として望ましいと思われますが、生徒は電池の一般的な作動原理がイオン化傾向に基づいているように考えてしまい、実用電池の作動原理を一つ一つ例外的に覚えていかなければならない状況にあります。例えば、自動車のバッテリーとして用いられている鉛蓄電池は極板に鉛と酸化鉛を用いており、その作動原理である次の反応はイオン化傾向では説明できません。
![]()
負極で鉛が酸化され、正極で酸化鉛が還元されて電池を構成しております。
また、最近話題の燃料電池も、酸素と水素が反応することによって電流を取り出しております。
![]()
負極で水素が酸化され、正極で酸素が還元されて電池を構成しております。授業において、正極、負極それぞれで還元反応、酸化反応が起こっていること、言い換えれば、電池の作動原理が一般的に酸化還元反応の親和力に起因していることを統一的に説明する指導が生徒の学習上の混乱を避けるうえでも望ましいのではないかと考えます。さらに付け加えれば、実用電池の代表格であるマンガン乾電池については、その反応がかなり複雑であるため、高校化学で教えるにはあまり適当ではないように思われます。
(2) 電気分解の学習指導について
電気分解に関して、教科書では多くの種類の溶液を電気分解して生成する物質や重要な法則である“ファラデーの法則”を教えています。例えば、教科書では次のような例題が登場します。
| 例題 | 硫酸銅(Ⅱ)CuSO4水溶液を白金電極を用いて5.00Aの電流で16分5秒間電気分解した。陰極で析出する銅の質量、陽極で発生する酸素の体積(標準状態)を求めよ。 |
しかし、教科書でファラデーの法則を確認する実験は、課題研究のテーマとして扱われていますが、その方法は、【図1】に示すとおり、両電極に銅板を用いて銅の質量の増減から確認することにしており、例題のような気体が発生するような実験を検証できる教材例は示されていません。
また図録でも中学校で扱うホフマン型の電解装置で水の電気分解を行い、発生する酸素と水素の体積からファラデーの法則を説明していますが、例題のような硫酸銅水溶液の電気分解の実験は扱っておりません。教科書や図録を用いた説明だけでは硫酸銅水溶液の電気分解を生徒に実感をともなって教えることが困難です。また、教師も適切な教材がないことから、現象を確認する実験だけにとどめて、ファラデーの法則を導く実験指導までには至っていない状況にあります。理科では、実体験が何よりも大切であり、新学習指導要領においても観察・実験がより一層重要視されておりますので、学習指導において効果的な教材が求められています。
(3) 電気分解を考慮した二次電池の学習指導について
電池には、充電を行うことができない一次電池と、充電を行うことで繰り返し使用することができる二次電池の二種類があります。二次電池が繰り返し使用できるのは正極・負極それぞれの活物質が再生されるためであり、そのために充電が行われるわけです。つまり、充電とは各活物質を再生させるための電気分解のことです。以上の観点から、現在は、一次電池(ダニエル電池)→二次電池(鉛蓄電池)→電気分解の学習順序になっておりますが、二次電池は電気分解の項目の後、電気分解の応用として扱うのが無理がないのではないかと考えます。
2 化学の学習における生徒の実態について
電池や電気分解などの電気に関する技術は、これからの技術社会を考えるうえでも非常に重要であると考えられていますが、前項で述べたとおり学習指導上効果的な教材の不足により、授業では問題演習中心になりがちです。理科では、実体験が重要視されているにもかかわらず現実に体験できない現象を問題として解かなければならず、生徒にとっては重要な現象を観念的に考えることを強いられて、この分野の学習に興味・関心が持てないとともに、苦手としている生徒が多い現状にあると思われます。そこで生徒の化学の学習に対する考え方の実態を調査するためにアンケート調査を行いました。対象は岩手県内のA高校の3年生163名(男子97名+女子66名)です。アンケートの結果を以下にあげます。
① あなたは化学が好きですか?
はじめに、「あなたは化学が好きですか?」の問いに対して、化学が好きであると答えた生徒は全体の30%しかおりませんでした。
化学が好きと答えた生徒の主な理由は、
・実験がおもしろい。
・身の回りの現象や物質が理解できる。
一方、化学が嫌いと答えた生徒の主な理由は、
・覚えることが多い。
・計算が面倒。
というものでした。女子生徒に多くの化学嫌いがいることも特徴的な傾向としてわかりました。
② あなたは化学の実験は好きですか?
次に、「あなたは化学の実験は好きですか?」の問いに対して、実験が好きであると答えた生徒は全体の80%近くもおりました。
実験が好きと答えた生徒の主な理由は、
・反応を見るのが楽しい。
・実際に体験することで理解が深まる。
・結果が得られたときがうれしい。
一方、実験が嫌いと答えた生徒の主な理由は、
・目的を把握しないで取り組んでいるので何をしているのかわからない。
・危険な作業が多い。
というものでした。
③ 教科書で化学の法則を読んだとき、どのように感じますか?
また、「教科書で化学の法則を読んだときどのように感じますか?」の問いに対して、読んで理解できる生徒もできない生徒も共に実験で確かめてみたいと答えた生徒は全体の80%近くもおりました。その他の答えとしては、
・法則は覚えるだけでよい。
・実験で理解はできないが、楽しいのでし
たい。
というものでした。
④ 定性実験と定量実験のどちらが好きですか?
さらに、「定性実験と定量実験のどちらが好きですか?」の問いに対しては、定性実験が好きであると答えた生徒は全体の60%近くもおりました。
以上のアンケート結果から、次のような高校生の一般像が浮かび上がってきます。
『化学は計算や覚えることが多くて苦手ではあるが、実験は実際に自分の目で確かめることができ、たのしいので好きである。ただし、現象面を確認する定性実験が好きであり、面倒な計算のある定量実験はきらいである。』
さらに、化学の学習項目毎に不得意と思われる項目を選ばせたところ、「酸化還元反応」と答えた生徒の割合が最も多く、その中で特に、電池や電気分解といった電気分野がわからないと答えた生徒は41.5%もおりました。酸化還元反応の電気分野は実用的な内容であり、生徒の興味・関心を引きそうでありながら、実際は計算が多く、また理論を追求する内容なので予想通り生徒には敬遠されていることが確かめられました。そこで、酸化還元反応の電気分野の学習において、生徒に興味・関心をもたせ、現象や法則の理解を深めさせる教材を開発することが学習指導の改善に役立つと考えました。
3 現象や法則の理解を深める教材の開発
(1) 教材開発の基本方針
酸化還元反応の電気分野の学習指導において現在必要とされている教材をまとめると次のようになります。
| ① 電池の原理を酸化還元反応の親和力で統一的な説明ができる教材 ② 電気分解において発生気体の体積からもファラデーの法則が理解でき、その気体を同定できる教材 |
電池には、放電のみを行うことができる一次電池と放電・充電を繰り返し行うことができる二次電池がありますが、二次電池の充電とは電気分解のことです。正極活物質が陽極に、負極活物質が陰極に完全に再生させるために充電が行われるわけです。そこで、教材開発を行うにあたり、電池の原理と電気分解の両方の現象の理解を深めることができる教材として電気分解装置の開発を考えました。教材開発を行うにあたり、次の点に注意しました。
① 生徒が理解しやすい簡単な原理を用いたもの ② 生徒が扱いやすいように操作が簡単であるもの ③ 観察しやすいように装置全体が見やすいもの ④ 繰り返し実験のできるもの ⑤ 自作しても実験誤差が小さくなるもの ⑥ 誰でも製作が可能であるもの ⑦ 安価に製作できるもの
(2) 開発教材の概要
全国理科教育大会(1997)で茨城県立水戸第一高等学校の萩谷氏らが発表した電気分解装置には次のような問題点がありました。
① 気体の体積を測定するために液だめを移動させる操作が慣れない生徒には難しい ② 容器の気密性が保てないことがある ③ 栓をするときに溶液をあふれさせることがある ④ 銅の質量を栓ごと測定するときに栓自体の汚れや濡れなどで誤差が目立つ
そこで、以上の問題点を考慮して【図2】に示す装置を開発しました。特徴としては、次の4点があげられます。
| ① | アクリル板を使用することで、反応状態が見やすいこと |
| ② | 三方コックを使用することで、本体注射筒内部に溶液を満たすことや、発生気体を捕集することが可能であること |
| ③ | 金属板は質量測定のため、取り外しやすいように洗濯ばさみで固定できること |
| ④ | 実験途中でも②の操作をすることによって再実験が簡単であること |
4 硫酸銅水溶液の電気分解に活用する方法
(1) 実験操作手順
開発した教材は、以下の手順にしたがって電気分解実験に活用することにしました。装置に流す電流値を一定にするために、はじめに予備実験を行わなければなりません。
| 【予備実験】 | |
| ① | 装置下部に白金電極を取り付ける |
| ② | 装置の開口部から0.5M-CuSO4・5H2Oを注ぎ入れる |
| ③ | 装置の注射筒の先端に、注射器付きの三方コックを取り付ける |
| ④ | 銅板を液槽に入れて溶液に浸すとともにアクリル角棒に接触させて、洗濯バサミで固定する |
| ⑤ | 流す電流を一定にするために、白金電極と銅板をそれぞれ外部電源の正極・負極に接続し、電源をONにして電流計を見ながら電流値を300mAに合わせるために電源装置のつまみを調節する |
| ⑥ | 電流値が300mAに一定した後、電源をいったんOFFにする |
| 【本実験】 | |
| ⑦ | 銅板を、質量を測定してあるものに取り替えてから再び電源装置に接続する |
| ⑧ | 三方コックを操作して注射器のピストンを引いて注射筒内部に硫酸銅水溶液を満たす |
| ⑨ | 電源をONにして、時間を正確に測定しながら2分おきに電源をOFFにする |
| ⑩ | 電源をOFFにした後、注射筒内部の水位と液槽の水位を液槽内部の水溶液をスポイトで吸い取ることで揃え、注射筒の目盛りで発生気体の体積を読み取る。 |
| ⑪ | 銅板をアクリル棒から取り外し、水で洗い流してからエタノールに浸して水を除去し乾燥させてから質量を測定する。 |
| ⑫ | 2分おきに同じ操作をくり返し、データを収集する。 |
(2) 実験データの整理について
ア 発生気体(酸素)の体積の理論値の求め方
陽極の白金電極では、次のような反応が起こっています。
すなわち、酸素が1モル発生する時には、電子が4モル必要です。そこで、注射筒内部の酸素の分圧と水蒸気圧の和が大気圧と釣り合っていれば、次の式で理論値を求めることが可能となります(ただし、発生気体の温度は水溶液の温度と一致しているものと見なします)。
イ 析出する銅の質量の理論値の求め方
陰極の銅板では、次のような反応が起こっています。
すなわち、銅が1モル析出する時には、電子が2モル必要です。そこで、次の式で理論値を求めることが可能となります。
(3) 実験結果および考察
ア 生成物と流した電気量の関係
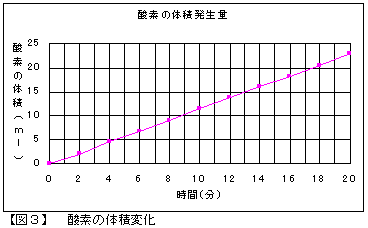
液温21℃、大気圧749.2mmHg、水蒸気圧=18.65mmHgの条件下で300mAの電流を流しました。理論的には、2分間の電気分解で酸素は2.34?発生、銅は0.012g析出することになりますが、実際のデータを【表1】に示します。
陰極に析出した銅の質量および陽極で発生した気体の体積と流した電気量との間には、【図3】・【図4】のグラフのとおり比例関係にあることから、ファラデーの電気分解の第一法則が確かめられます。
 |
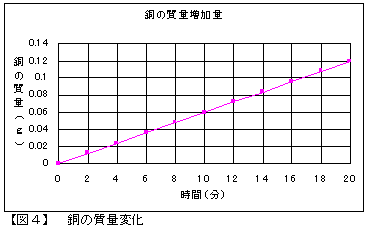 |
また、実験開始から20分を経過して、O2の誤差率は1.7%、Cuの誤差率は0.0027%でした。酸素の理論値と実測値の間に少し開きがあったことに関しては、溶液中に溶解した酸素の影響があったためではないかと思われます。実験に用いた水溶液の量は500?と多量であり、酸素は水に溶けにくい気体ではありながら、溶解量を無視できない結果があらわれたものと思われます。しかし、酸素の発生量・銅の析出量ともに誤差の程度は小さく、実験結果として有効なデータが得られたものと考えます。
イ 一定の電気量によって変化する物質量とイオンの価数の関係
300mAの電流を10分間流したときの電子の物質量と陰極に析出した銅の物質量、および陽極に発生した気体の物質量は次のとおり求められます。
したがって、電子の物質量と析出した銅の物質量の比と、電子の物質量と発生した気体の物質量の比は次のとおりとなります。
上記の計算結果より、一定の電気量を流したとき、電極で変化するイオンの物質量は、イオンの価数に反比例することが確認できます。このことから、ファラデーの電気分解の第二法則が確かめられました。
ウ 発生した気体の定性分析
発生した気体を捕集して燃えている線香を近づけたところ、激しく燃えたことから、
陽極に発生した気体は酸素であることが確認できました。
5 二次電池に活用する方法
二次電池を作動させるためには、電気分解による正極・負極の各活物質が充電(電気分解)によって再生されることが必要です。充電(電気分解)によって陽極で水溶液から生成される代表的な酸化剤には、塩素(Cl2)・臭素(Br2)・ヨウ素(I2)が考えられます。塩素・臭素・ヨウ素は元素の周期表では同じ17族に属し、ハロゲンと呼ばれています。このハロゲンはいずれも1価の陰イオンになりやすく(反応相手から 電子を受け取りやすい、すなわち酸化剤となり得る)、酸化剤としての強さは、塩素(Cl2)>臭素(Br2)>ヨウ素(I2)の順序となっています。これは高校化学で必ず学習する内容であり、酸化剤として扱う素材として申し分ないものと考えられます。一方、充電(電気分解)によって陰極で水溶液から生成される代表的な還元剤には、ほとんどすべての電池で用いられている亜鉛(Zn)が考えられます。亜鉛は比較的イオン化傾向が大きいので2価の陽イオンになりやすい金属です。また、イオン化傾向の大きいナトリウム、マグネシウム、アルミニウムのように、その塩類の水溶液を電気分解しても水素は発生せず、亜鉛単体が析出します。したがって、二次電池のモデルに扱う素材として、亜鉛-ハロゲン系電池が最もふさわしいと考えて、電解液に(ハロゲンイオン・亜鉛イオン)混合水溶液を、電極に白金電極と亜鉛板を用いることにしました。ハロゲン-亜鉛電池の充電・放電反応は【図6】に示すとおりです。
(2) 実験操作手順
開発した教材は、以下の手順にしたがって二次電池実験に活用することにしました。電池としての作動確認はソーラーモーターを、電圧測定にはデジタルマルチメーターを使用します。
| ① | 装置開口部から、0.5M-(Zn2++Clー)混合溶液(具体的にはZnSO4+KCl)、または0.5M-(Zn2++Brー)混合溶液(具体的にはZnSO4+KBr)、または0.5M-(Zn2++Iー)混合溶液(具体的にはZnSO4+KI)を注ぎ入れる |
| ② | 装置下部に白金電極を取り付ける |
| ③ | 亜鉛板を液槽に入れて溶液に浸すとともにアクリル角棒に接触させて、洗濯バサミで固定する |
| ④ | 白金電極と亜鉛板をそれぞれ電源の正極、負極に接続する |
| ⑤ | 電源をONにして、数分間電気分解(充電)を行う それぞれの電極で活物質となるハロゲンと亜鉛が生成されればいいので、電流値や時間は特に定めないことにする 陽極で起こる変化を観察する |
| ⑥ | 電源をOFFにして、リード線を電源装置からはずし、電池として作動するかソーラーモーターに接続する |
| ⑦ | 再び数分間電気分解を行ってそれぞれの電極に活物質を生成させてから、それぞれの電極をデジタルマルチメーターに接続して電池としての起電力を測定する |
(3) 実験結果および考察
ア 電気分解(充電)時における陽極の変化
各ハロゲンイオン・亜鉛イオン混合溶液を電気分解したときの陽極の変化を【表2】にまとめました。
(Zn2++Clー)混合溶液を電気分解した時に生成する気体は、臭いや水に対する溶解度が大きいことなどから判断して塩素と考えられます。
(Zn2++Brー)混合溶液を電気分解した時に生成する褐色物質は、色から判断して臭素と考えられます。また、同時に生成する気体は、水の電気分解による酸素と考えられます。
(Zn2++Iー)混合溶液を気分解した時に生成する赤褐色物質は、色から判断してヨウ素と考えられます。本来、固体のヨウ素は水に溶けにくいのですが、ヨウ素イオンが共存している場合には、
I2 + I-→I3- という反応が起こり、ヨウ素溶液になっているものと考えられます。また、同時に生成する気体は、(Zn2++Brー)混合溶液の電気分解のときと同様、水の電気分解による酸素と考えられます。
いずれの水溶液の電気分解においても、酸化剤と成り得るハロゲンが生成してきていることが確かめられました。
イ 電池としての起電力
電気分解後、すぐにソーラーモーターに接続するとモーターを回転させたり、電子メロディーにつなぐと音が鳴ることなどから、電池が形成されていることが確かめられました。また、その起電力は、表4の標準酸化還元電位の差から理論値を求めることができます。各水溶液を電気分解したときの起電力の実験値と理論値は次の表のとおりになりました。
標準酸化還元電位の異なる化学種同士で電池を作った場合、電位の高い方が正極、電位の低い方が負極となります。つまり、各ハロゲン-亜鉛電池の作動原理は以下のとおりとなっています。
起電力の実験値は、ここで求めた理論値にかなり近い値を示しており、電池としての性能の精度の高さが確かめられました。
次に、ハロゲンの酸化力比較実験の結果については、写真1の左から実験操作①~③の結果を示します。
①では、2KBr+Cl2→2KCl+Br2 の反応が起こり、遊離したBr2 がヘキサン層に溶けて褐色を示しています。 ②では、2KI+Cl2→2KCl+I2 の反応が起こり、遊離したI2 がヘ キサン層に溶けて紫色を示しています。 ③では、2KI+Br2→2KBr+I2 の反応が起こり、遊離したI2 がヘ キサン層に溶けて紫色を示しています。
以上の結果から、ハロゲン物質の酸化力の強さは、
Cl2 > Br2 > I2 となることがわかります。
したがって、ハロゲン物質の酸化力の強さが、電池の起電力の
大きさに関係していることが確認できました。
6 開発実験教材を用いた授業実践
(1) 学習指導試案の概要
研究協力校において、開発した教材を用いた授業の指導試案を以下に示します。
ア 指導目標
開発した実験装置を活用して、電池・電気分解に対して興味・関心を引き出しながら、その反応の現象や法則の理解を深める。
イ 指導計画への位置づけ
単元「酸化・還元反応」における「電池」「電気分解」の学習で行う。
ウ 指導の展開
(2) 指導実践及び実践結果の分析と考察
ア 対象
岩手県立花巻南高等学校 2年生(理系)42名 (男子26名、女子16名)
イ 授業実践期間
平成12年6月23日~7月3日(4時間)
ウ 授業実践の概要
指導試案に基づいて授業実践を行った。写真3、写真4、写真5に生徒の活動の様子を示します。
写真3は、硫酸銅水溶液を電気分解する実験を行っている様
子です。発生する酸素の体積測定や銅板の質量測定をできるだ
け正確に行おうと意欲的に活動していました。また、すべての生徒に役割を分担したことにより、与えられた仕事を一所懸命
に取り組もうとする誠実さが伺えました。各班とも、すぐに実験装置の操作に慣れ、良いデータが得られたことに満足していました。気体の反応を観察し、実験データを分析することによ
り、定性実験と定量実験の両方についてバランスのとれた学習活動ができました。
写真4は、ハロゲン-亜鉛電池の実験を行っている様子です。三種類の水溶液を順番に電気分解(充電)させるために、溶液
の入れかえにやや手間取っていたようでしたが、それぞれの水溶液の電気分解における陽極の変化や電子メロディーの音が鳴
ったことに驚いていました。起電力の大きさについては、乾電池1個の電圧が1.5Vであることと比較して考えていました。
写真5は、ハロゲン-亜鉛電池の電気分解(充電)時に得られた陽極の生成物であるハロゲン物質の酸化力の比較実験を行っ
ている様子です。溶液を混ぜるだけですが、いずれの生徒も興味・関心を持ち、そこで起こる化学変化の色を熱心に観察していました。
理論値と比較させながらデータを集めることで化学反応が計算どおり起こっていることに感動していた生徒や、生成物の化学変化に興味を持って見つめている生徒を見て、今回の授業が化学的に探究する能力や態度を育てることにもつながっていることを感じました。
 |
 |
 |
エ 結果の分析と考察
授業後に行ったアンケート結果は次のとおりです。
| ①実験は楽しかったですか? |
| ・楽しかった (83%) ・少し楽しかった (12%) ・あまり楽しくなかった ( 5%) ・まったく楽しくなかった ( 0%) |
| ②使用した装置は使いやすかったですか? |
| ・使いやすかった (66%) ・少し使いやすかった (29%) ・あまり使いやすくなかった ( 5%) ・まったく使いやすくなかった ( 0%) |
| ③使用した装置は、あなたの学習内容の理解に役立ちましたか? |
| ・役立った (33%) ・少し役立った (60%) ・あまり役立たなかった ( 7%) ・まったく役立たなかった ( 0%) |
| ④実験を通じて生成物の質量や体積の求め方が理解できましたか? |
| ・理解できた ( 2%) ・少し理解できた (63%) ・あまり理解できなかった (33%) ・まったく理解できなかった ( 2%) |
| ⑤実験を通じてファラデーの法則が理解できましたか? |
| ・理解できた ( 5%) ・少し理解できた (45%) ・あまり理解できなかった (48%) ・まったく理解できなかった ( 2%) |
| ⑥実験を通じて電池の作動原理が理解できましたか? |
| ・理解できた (31%) ・少し理解できた (31%) ・あまり理解できなかった (36%) ・まったく理解できなかった ( 2%) |
| ⑦実験は操作や解析を含めて参考になりましたか? |
| ・参考になった (58%) ・少し参考になった (40%) ・あまり参考にならなかった ( 2%) ・まったく参考にならなかった ( 0%) |
| ⑧電気分解について興味が持てるようになりましたか? |
| ・持てるようになった (33%) ・少し持てるようになった (62%) ・あまり持てるようにならなかった ( 5%) ・まったく持てるようにならなかった ( 0%) |
| ⑨電池について興味が持てるようになりましたか? |
| ・持てるようになった (36%) ・少し持てるようになった (57%) ・あまり持てるようにならなかった ( 7%) ・まったく持てるようにならなかった ( 0%) |
| ⑩酸化還元反応について興味が持てるようになりましたか? |
| ・持てるようになった (26%) ・少し持てるようになった (60%) ・あまり持てるようにならなかった (14%) ・まったく持てるようにならなかった ( 0%) |
以上のとおり、「学習内容についての興味・関心」、「実験装置の有効性」、「実験内容の評価」について、良好な結果を多くの生徒から得ることができました。しかし、④~⑥について、ややマイナス傾向の回答が多かったことについては、もともと比例・反比例計算が不得意な生徒が多くおり、事前指導だけでは計算能力を高めることができなかったことによると思わます。
次に、生徒の主な感想文をあげます。
①硫酸銅水溶液の電気分解実験について
・「実際に酸素や銅を見たりして、問題だけで解いていたことが更に理解でき、確認することができて良かった。」
・「理論値と実験値が一致したのでとても感動したし、mg単位での測定は精密さを実感できたので良かった。」
・「いままでやった電気分解の実験を考えると、今回の装置の方が使いやすかったと思う。」
②電池実験について
・「こんなに簡単に電池が作れるなんて現代の科学に驚き、喜んでいます。化学に興味がわき、実験が好きになりました。」
・「電池のつくりについて、今まではとても難しいというイメージしかなかったのが、わかりやすい装置によって理解できました。」
③実験装置について
・「三方コックを使用することで、溶液を満たしたり気体を集めたりするのが使いやすかった。」
・「実験装置は全体が透明なので化学反応が見やすく、また気体の体積をすぐに確認することができて使いやすかった。」
④実験全体について
・「実験を通して、化学のことが理解できるようになったし、化学がおもしろく感じた。」
・「すべての実験が楽しく、化学の勉強をしたという実感が持てた。」
生徒のアンケートおよび感想文から多くのプラス傾向の回答や感想が得られたことから、開発した教材を活用した授業実践は、酸化還元反応の電気分野の学習内容について興味・関心を高めることと、学習内容の理解を深めることに有効であったと考えられます。
7 研究のまとめと課題
(1) 研究のまとめ
本研究における本年度の研究目標は、2年次研究の第2年次として、昨年度開発した実験教材を用いた授業の基本構想と指導試案を立案し、立案した指導試案に基づく授業実践を行い、その結果を検討することでした。研究協力校において指導試案に基づく授業を実践した結果、生徒のアンケートや感想文等から開発教材を用いた授業が、酸化還元反応の電気分野について興味・関心が高められ、かつ現象や法則の理解を深めることに有効であることがわかりました。
(2) 今後の課題
新学習指導要領では、情報の収集・検索、計測・制御、結果の集計・処理においてコンピュータを効果的に活用することが明記されています。本研究で開発した教材をどのようにコンピュータと組み合わせて活用できるかが今後の課題となります。
おわりに
この研究を進めるにあたり、貴重な助言と研究内容の検討を頂きました研究協力校の校長先生をはじめ諸先生方、並びに研究協力員の先生方に心から感謝申し上げます。
【参考文献】
1) 「化学と教育」, 45号(1997).
2) 萩谷薫・三村千春・市毛正道,日本理化学協会・「全国理科教育大会発表資料集」(1997)
3) 日本分析化学会編, 「分析化学データブック(改訂3版)」, 丸善(株)(1983)
4) 日本化学会編, 「高校化学の教え方」, 丸善(株)(1997)
5) 教科書:東京書籍, 「化学ⅠB」 など
6) 図 録:東京書籍, 「ビジュアルワイド図説化学」 など
7) 田中善正・大倉洋庸・斉藤 寛, 「分析化学Ⅰ(改訂4版)」, 南江堂(1997)
8) 重松栄一, 「化 学 ~物質の世界を正しく理解するために~」, 民衆社(1996)
9) ト部吉庸, 「化学ⅠB・Ⅱの新研究」, 三省堂(1997)